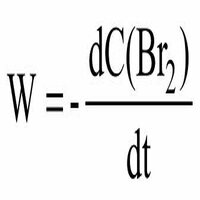 В сложных реакций относятся последовательные, параллельные, сопряженные, обратимые и др..
В сложных реакций относятся последовательные, параллельные, сопряженные, обратимые и др..
В сложных реакциях химический процесс протекает не путем прямого перехода молекул исходных веществ в молекулы продуктов реакции, а состоит из нескольких стадий. Каждую, из этих стадий нельзя рассматривать как самостоятельную химическую реакцию. Реакции, идущие путем прямого перехода реагирующих частиц в продукты реакции, называют элементарными. Существует положение о независимости протекания элементарных реакций, согласно которому константа скорости элементарной реакции не зависит от того, происходят ли в данной системе одновременно другие элементарные реакции. Каждая элементарная реакция описывается своим кинетическим уравнением. Кинетическое уравнение сложной реакции, как отмечалось, определяется лимитирующей реакцией.
Рассмотрим некоторые сложные реакции. Последовательные реакции. Последовательными реакциями называют химические (или технологические) процессы с промежуточными стадиями. Можно сказать, что практически почти все химические процессы многостадийным последовательными реакциями. Механизм таких реакций часто неизвестен. Поэтому составляют вероятную схему прохождения реакции по стадиям и определяют общее кинетическое уравнение суммарной реакции. Такие расчеты очень сложны, если учитывать, что реакция в целом и отдельные ее стадии могут быть обратимыми. Поэтому рассмотрим простейший случай - мономолекулярную необратимую последовательную реакцию в которой происходит две односторонние мономолекулярные реакции. Вещество В является промежуточным продуктом в процессе получения вещества С.
Примером такой реакции может быть радиоактивный распад радия или гидролиз крахмала в водной среде: крахмал ® декстрин ® мальтоза ® глюкоза. Эта реакция происходит в присутствии катализатора и при избытке воды.
Рассмотрим случай, когда константы скорости К1 и К2 отличаются не более чем на порядок. Тогда обе стадии является лимитирующим. Если К2 >> К1 или К1 >> К2, то скорость суммарной реакции равна скорости самого медленного промежуточной реакции. В первом случае это первая стадия, а во втором - вторая.
Параллельные реакции. Для таких реакций исходное вещество изменяется в двух или более направлениях. Рассмотрим простую параллельную реакцию первого порядка